Билет № 9
2. Адсорбция. Физическая и химическая адсорбция. Коэффициент прилипания.
Адсорбция
Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — это, в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Адсорбция и хемосорбция
На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Схожие явления
В предыдущем разделе говорилось о случае протекания гетерогенной реакции на поверхности- хемосорбции. Однако бывают случаи гетерогенных реакций по всему объему, а не только на поверхности- это обычная гетерогенная реакция. Поглощение по всему объёму может проходить и под воздействием физических сил- этот случай называется абсорбцией.
|
Виды взаимодействий |
Взаимодействия только на поверхности |
Взаимодействия по всему объёму |
|
Физические |
Адсорбция |
Абсорбция |
|
Химические |
Хемосорбция |
Гетерогенная реакция |
Физическая адсорбция
Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
|
Модели физической адсорбции |
|
|
Образование монослоя |
Энергетическая диаграмма |
|
|
|
|
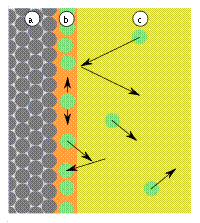
Рис. 1: a) адсорбент, b) адсорбат, c) адсорбтив (газовая фаза или раствор) |
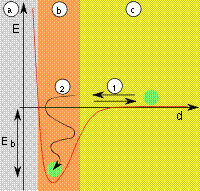
Рис. 2: a) адсорбент, b) адсорбат, c) газовая фаза, d - расстояние, E - энергия, Eb- энергия адсорбции, (1) десорбция, (2) адсорбция |
|
Поликонденсация |
Избирательная адсорбция |
|
|
|
|
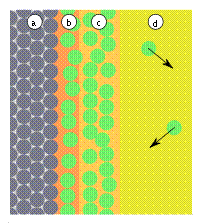
Рис. 3: a) адсорбент, b) адсорбат, c) конденсат, d) адсорбтив (газовая фаза или раствор) |
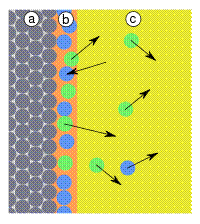
Рис. 4: a) адсорбент, b) адсорбат, c) адсорбтивы (газовая фаза или раствор): показана преимущественная адсорбция частиц голубого цвета |
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
![]() ;
;
уравнение равновесияя в таком случае:
![]() ,
,
где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
![]() ,
,
где θ — доля площади поверхности адсорбента, занятая адсорбатом, α — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку [S − P] = θ и, соответственно, [S * ] = 1 − θ, уравнение адсорбционного равновесия может быть записано следующим образом:
![]()
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Значение адсорбции
Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ.
Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. Пример адсорбционных установок приведён на странице азотные установки.
Установка для проведения адсорбции называется адсорбером.
Адсорбция представляет практическое значение для широкого круга проблем и процессов. В общем случае адсорбция означает связывание на поверхности атома или молекулы, пришедших либо из пара, окружающего образец, либо из объема образца в результате диффузии. Поглощение молекул твёрдым телом называется сорбцией, обратный процесс — десорбцией, а поглощающее тело — сорбентом. При физической адсорбции молекулы удерживаются на поверхности силами Ван-дер-Ваальса. Эти связи не сопровождаются переносом заряда от подложки к адатому или наоборот.
Чаще же всего происходит обмен электронами между адсорбированной молекулой поверхностью, при котором образуется довольно сильная химическая связь между ними и о молекуле говорят, что она хемосорбирована. Хемосорбция сопровождается образованием валентных связей молекул газа с поверхностью. Крайний случай хемосорбции – когда все валентные электроны уходят от адсорбированной молекулы на ближайший атом подложки (или наоборот). На поверхности системы может быть связано много большее число молекул по сравнению с числом молекул свободно летающих в объёме.
Абсорбция – это растворение газа в материале.
Нагревание поверхности сообщает молекулам добавочную энергию для преодоления потенциального барьера и приводит к десорбции. Охлаждение и нагревание рабочей поверхности вызывает адсорбцию и десорбцию молекул – это явление широко используется при получении вакуума.
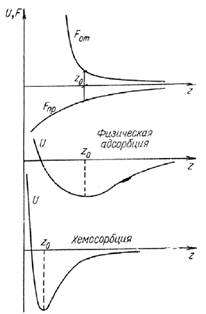
Рис. 7. Потенциальные ямы при адсорбции
Граница физической адсорбции и хемосорбции: U >/< 0,1 эВ (U - глубина ямы).